للإجابة على هذا السؤال، يجب أولًا فهم ما نعنيه بـ”المعدي”. في السياق الطبي، يشير مصطلح “معدي” إلى أي مرض قابل للانتقال من شخص لآخر، سواء كان ذلك عن طريق الهواء، اللمس، أو السوائل الجسدية. حتى اللحظة، الأدلة العلمية تشير إلى أن مرض ألزهايمر ليس “معديًا” بهذا التعريف الصارم. مرض ألزهايمر هو اضطراب عصبي تنكسي ينشأ بسبب تراكم غير طبيعي لبروتينات معينة في الدماغ، مثل بروتينات تاو وأميلويد بيتا، مما يؤدي إلى تلف الخلايا العصبية وفقدان الوظيفة العقلية بمرور الوقت.
ومع ذلك، ثمة دراسات حديثة تستكشف إمكانية “العدوى” بمعنى أوسع، متعلقة بانتقال بروتينات أميلويد بيتا المرتبطة بألزهايمر تحت ظروف معينة، مثل الإجراءات الجراحية التي تستخدم أدوات طبية غير معقمة بشكل كافٍ.
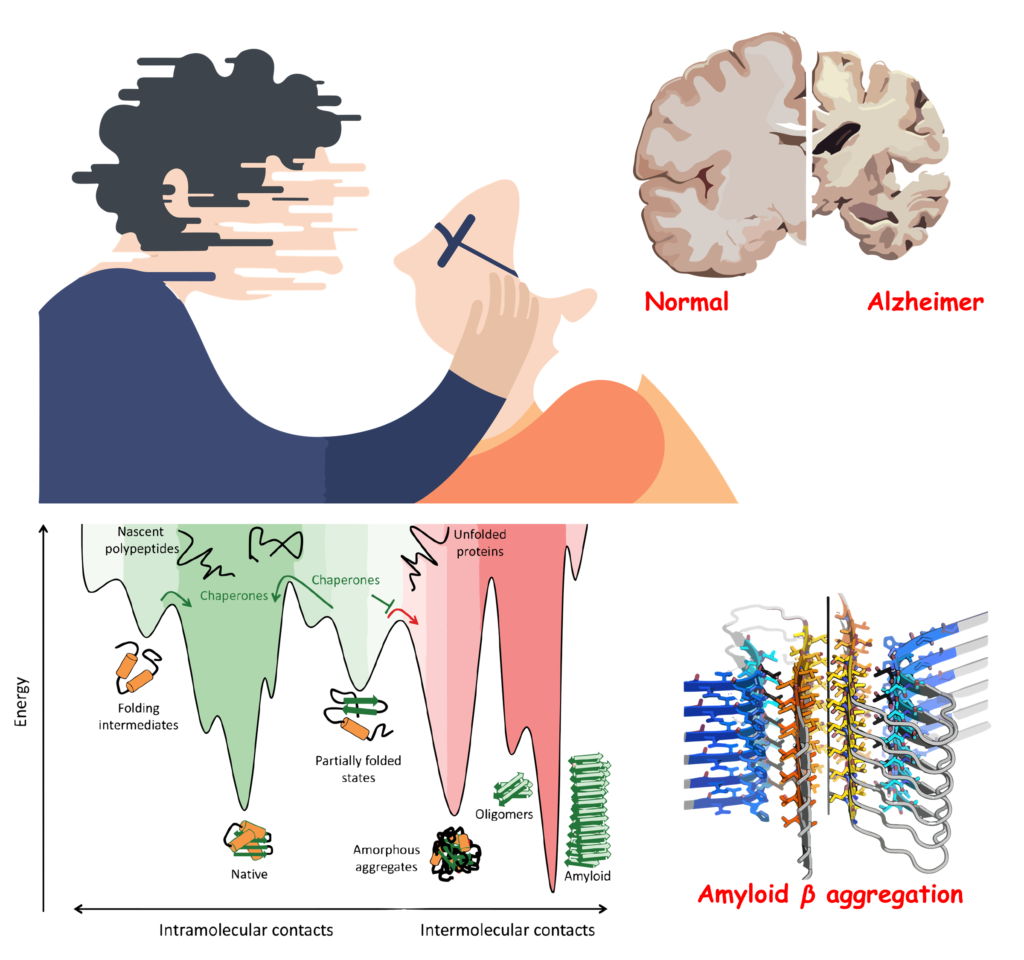
يلعب بروتين أميلويد بيتا دورًا محوريًا في تطور مرض ألزهايمر، وهو يأتي في عدة أشكال تؤثر على وظائفه وتأثيراته داخل الدماغ. الفهم العميق لهذا البروتين يكشف عن وجهين له: واحد وظيفي مستقر يعمل ضمن النطاق الطبيعي للعمليات الخلوية، والآخر، أكثر استقراراً وغير وظيفي، يمكن أن يتسبب في تفاقم حالات الخرف مثل ألزهايمر. الشكل الأكثر استقرارا لبروتين أميلويد بيتا مستقر هيكليا لدرجة انه يصعب هضمه من خلال انزيمات و احماض الجهاز الهضمي و كذلك يصعب تحليله و السيطرة عليه من خلال الخلايا المناعية في المخ.
الشكل الوظيفي المستقر من بروتين أميلويد بيتا هو جزء من العمليات الفسيولوجية الطبيعية، مشاركًا في عدة وظائف بيولوجية مثل تنظيم النشاط العصبي وحماية الخلايا العصبية. ومع ذلك، الشكل الغير وظيفي، الذي يتميز بمزيد من الاستقرار، يمكن أن يكون له تأثيرات مدمرة على الدماغ. هذا الشكل يميل إلى التجمع وتشكيل لويحات أميلويد، وهي ترسبات بروتينية تتكون في الفضاء بين الخلايا العصبية وتعد من السمات المميزة لمرض ألزهايمر.
الجانب الأكثر إثارة للقلق بخصوص الشكل غير الوظيفي هو قدرته على التصرف كقالب، حيث يمكنه “حث” أو تحفيز بروتينات أميلويد بيتا الأخرى لتتخذ الشكل غير الوظيفي عالي الاستقرار. هذه العملية تعرف بالتنسيق الذاتي (self-seeding)، حيث يمكن لجزيء واحد من البروتين أميلويد بيتا غير الوظيفي تحفيز تحول جزيئات أخرى إلى نفس الحالة غير الوظيفية، مما يسرع من تكوين اللويحات الأميلويدية وتطور المرض.
هذه الخاصية لبروتين أميلويد بيتا توضح لماذا يعد تراكم هذه البروتينات مشكلة مركزية في مرض ألزهايمر. القدرة على “التلقيح” أو “التنسيق الذاتي” تساهم في الانتشار السريع لتراكم البروتين غير الوظيفي داخل الدماغ، مما يؤدي إلى تلف الخلايا العصبية وفقدان الوظيفة الإدراكي.
مرض جنون البقر يعد مثالاً آخر على الأمراض الناتجة عن تراكم بروتينات بنية غير طبيعية في الدماغ، والتي تشارك آليات مماثلة لما يُرصد في مرض ألزهايمر، خاصةً فيما يخص عملية تحول البروتين والتجمع البروتيني.
في سياق مرض جنون البقر، البروتين المسبب للمرض هو بروتين بريون والذي يمكن أن يتخذ شكلين رئيسيين: الشكل الطبيعي الذي يؤدي وظائف فسيولوجية معينة وشكل غير طبيعي مرضي (مستقر هيكليا بشكل كبير) يسبب التجمعات البروتينية وتلف الأنسجة العصبية.
البروتين البريوني المرضي، الذي يتميز بكونه أكثر استقرارًا ومقاومة للهضم، لا يتم التخلص منه بسهولة من قبل الجسم. عندما يتراكم هذا البروتين في الدماغ، يبدأ في تحفيز تحول البروتينات البريونية الطبيعية إلى الشكل المرضي، مما يؤدي إلى تجمعات بروتينية تسبب تدهورًا واسع النطاق للأنسجة الدماغية. هذا التدهور ينتج عنه ظهور فجوات مجهرية في الدماغ تُعطي مظهرًا يشبه الإسفنج، مما يعطي المرض اسمه “الإسفنجي”.
التشابه بين مرض جنون البقر ومرض ألزهايمر يكمن في أساس الآلية التي تؤدي إلى تراكم البروتينات غير الطبيعية والتجمعات البروتينية داخل الدماغ. في كلتا الحالتين، البروتينات غير الطبيعية (بروتينات أميلويد بيتا في ألزهايمر، والبروتينات البريونية المرضية في جنون البقر) تتجمع وتؤدي إلى تلف الأنسجة العصبية، مما يؤدي إلى تدهور وظائف الدماغ.
في العقود الأخيرة، شهدت القدرات الحاسوبية تطورات مذهلة، مما فتح آفاقاً جديدة في مجالات البحث العلمي والطبي، خاصةً في دراسة البروتينات وآليات طيها. هذا التقدم له أهمية خاصة في فهم الأمراض العصبية التنكسية مثل مرض ألزهايمر ومرض جنون البقر، حيث يلعب طي البروتين دوراً مركزياً في تطور هذه الحالات.
محاكاة طي البروتينات بدقة عالية توفر إمكانيات لا مثيل لها للعلماء لاستكشاف كيف تطوي البروتينات نفسها من سلاسل أمينية خطية إلى أشكال ثلاثية الأبعاد معقدة، والتي تحدد وظيفتها في الجسم. الفهم الدقيق لهذه العملية مهم بشكل خاص لأن الطي غير الصحيح يمكن أن يؤدي إلى تشكيل تجمعات بروتينية غير طبيعية مرتبطة بالعديد من الأمراض.
يمكن للمحاكاة الحاسوبية أن تكشف كيف تتفاعل البروتينات مع بعضها البعض على المستوى الجزيئي وكيف تؤثر هذه التفاعلات على طي البروتين واستقراره. بفهم كيف يسهم الطي غير الطبيعي وتجمع البروتينات في تطور الأمراض العصبية، يمكن تطوير استراتيجيات للتدخل ومنع هذه العمليات، و معرفة كيفية تفاعل البروتينات المرضية يمكن أن توجه تصميم مركبات جديدة تستهدف بشكل خاص هذه البروتينات، مما يمنع تجمعها أو يعزز تحللها.
إحدى النجاحات البارزة في هذا المجال هو مشروع “Folding@Home”، وهو مشروع حوسبة موزعة يستخدم قوة معالجة أجهزة الكمبيوتر الشخصية حول العالم لمحاكاة طي البروتينات. هذا المشروع وغيره من الأدوات الحاسوبية المماثلة قد ساهمت بشكل كبير في توسيع فهمنا لطي البروتين ودوره في الأمراض العصبية التنكسية.
بالرغم من التحديات القائمة، فإن التطورات الحاسوبية الحديثة تقدم أملاً كبيراً في مجال البحث الطبي وتعد بإمكانيات هائلة لفهم أعمق وأكثر شمولاً للأمراض مثل ألزهايمر وجنون البقر، وتوفر الأساس لتطوير استراتيجيات جديدة وفعالة للعلاج والسيطرة على هذه الحالات.